集中治療におけるリハビリテーションの役割
この記事は、大いに私見を含みながら、私自身が日々どのようなことを考えながら重症患者さんに接しているのかをまとめたものです。
したがって、ここで示す内容は厳密なエビデンスの解説というよりも、臨床現場での思考過程が中心になります。その点はあらかじめご理解ください。
集中治療室(ICU)を含む重症患者に対してリハビリテーションを行う大きな目的のひとつは、PICS(Post Intensive Care Syndrome:集中治療後症候群)の予防です。
ICUに入室し、治療を受けた患者さんは退室後にさまざまな問題を抱えることがあります。身体機能の低下、認知機能障害、精神的問題などが複合的に生じるPICSは、社会復帰や生活の質(QOL)を大きく左右するため、リハビリテーション介入において常に念頭に置くべき課題だと考えています。
PICSの構成要素
PICS(Post Intensive Care Syndrome:集中治療後症候群)は、身体・認知・精神の3つの構成要素から成り立ちます。
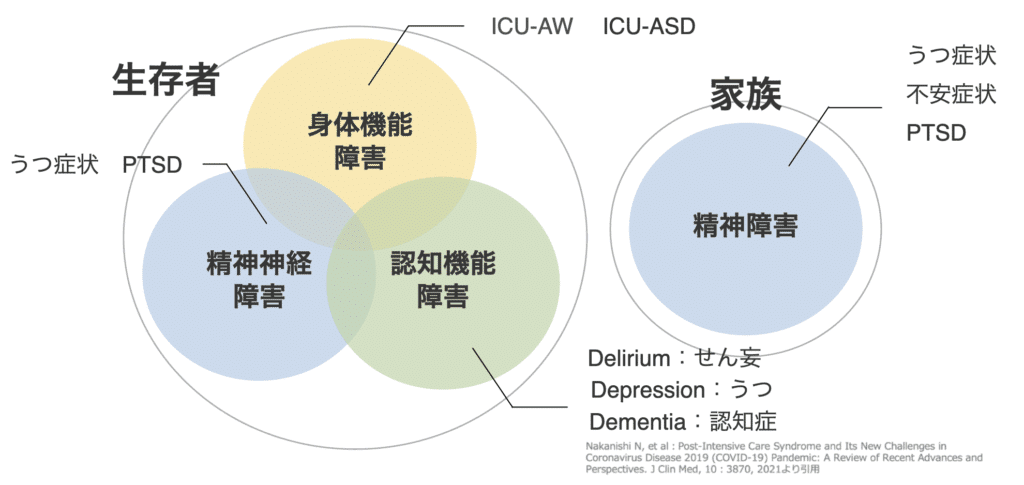
- 身体的問題:筋力低下や持久力の低下により、日常生活動作(ADL)が制限される。長期臥床やICU-AW(ICU-Acquired Weakness)が大きな要因。
- 認知的問題:記憶力や注意力の低下、遂行機能障害などが見られ、社会復帰や職場復帰を難しくする。
- 精神的問題:うつ、不安、PTSDといった心理的障害が長期にわたり生活の質を損なう。
これら3つは単独で現れることもあれば、複合的に重なり合い、互いに悪影響を及ぼすことで患者の予後をさらに悪化させます。
PICSになると何が悪いのか
1)長期予後が悪化する
ICU生存者は退院後も死亡リスクが高く、身体・認知・精神の多領域にわたる機能低下を抱えることが知られています。報告によると数年単位に及ぶ影響と医療資源利用の増加が強調されています1)。さらに、日本の研究では、敗血症患者において退院3か月時点でPICSを呈していた群は、非PICS群と比べて2年後の生存率が有意に低下していたことが示されています2)。
2)QOL/ADL/IADLが低下する
系統的レビューやコホート研究により、一般人口と比べてQOLが有意に低い状態が長期間持続することが明らかになっています3)。特にARDSや重症敗血症、長期人工呼吸などの症例では低下が顕著です。ARDS生存者を対象にした古典的研究では、退院後1年経過しても6分間歩行距離やSF-36のスコアが著しく低下したままであり、身体面の障害が長期に残ることが報告されています4)。
3)再入院率が増える
退院後1年間の追跡で、ICU生存者の再入院は非ICU群より約60%高いという大規模集団ベース研究があります5)。さらに、ICU退室後の再入室や病棟への再入院は、入院死亡率や在院日数の増加と関連することも多施設解析で示されています6)。
4)就業復帰率が低下する
メタ解析によると、退院12か月時点での復職率はおおむね60〜70%にとどまり、復職できても労働能率の低下や収入減少が目立つと報告されています7)。
5)家族(PICS-F)にも悪影響が及ぶ
PICSの影響は患者本人にとどまらず家族への影響も報告されています。患者家族もまた、ICUでの経験を契機に不安・うつ・PTSDといった心理的問題を長期に抱えうることが知られています。この現象は PICS-F (Family) と定義され、退院後数年以上持続するケースも報告されています8)。
6)嚥下機能も低下する(ICU後嚥下障害)
ICU滞在後には嚥下障害が高率に発生し、誤嚥性肺炎、経口摂取再開の遅延、栄養不良、QOL低下、在院延長、死亡リスク増加と関連することが報告されています9)。嚥下障害はしばしば見過ごされがちですが、退院後の生活の質に直結するため、早期の評価と介入が必要です。
PICSを予防するための戦略 ― ABCDEF(GH)バンドルの全体像
PICSを予防するうえで、いまや世界的に広く推奨されているのが ABCDEFバンドル です。これは集中治療の現場で実践すべきケアを体系化したもので、単一の職種や治療にとどまらず、多職種で連携しながら患者さんを包括的に支援する枠組みといえます10)12)。
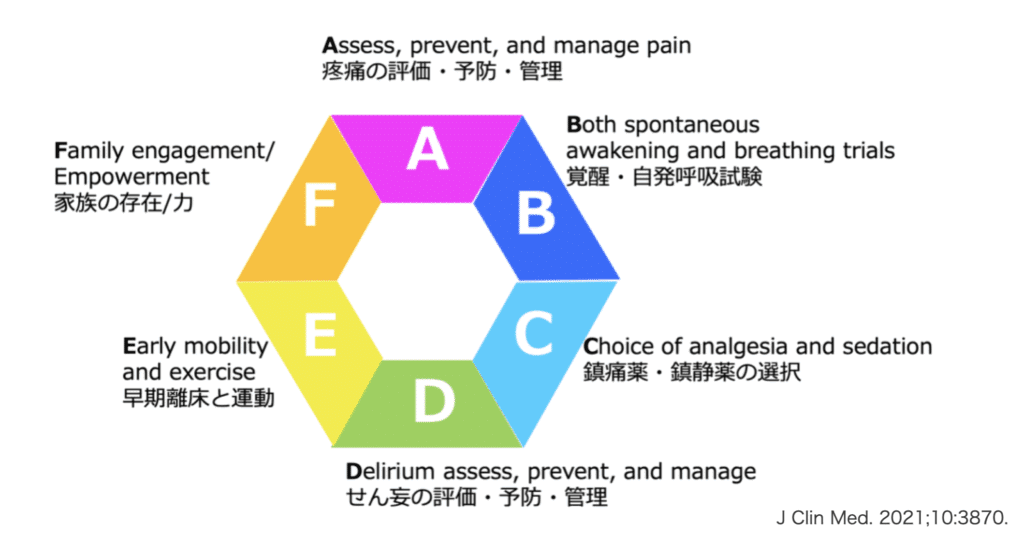
バンドルを構成する要素は以下の通りです。
- A:Assess, prevent, and manage pain(疼痛の評価・予防・管理)
- B:Both spontaneous awakening and breathing trials(自発覚醒・自発呼吸トライアルの併用)
- C:Choice of analgesia and sedation(鎮痛・鎮静薬の適切な選択)
- D:Delirium assessment, prevention, and management(せん妄の評価・予防・管理)
- E:Early mobility and exercise(早期離床・運動療法)
- F:Family engagement and empowerment(家族の参加とエンパワーメント)
さらに近年は、
- G:Good communication(チーム内外の円滑な情報共有)
- H:Handout/Follow-up(退室後の支援とフォローアップ)
といった要素を加えた ABCDEF-GHバンドル という形で捉えられることもあります11)。
バンドルの効果
研究では、このバンドルを徹底して実践することで以下のような効果が示されています。
- 機械換気日数の短縮
- ICU在室日数の短縮
- せん妄発症率の減少
- 退院後の機能障害やQOL低下の抑制
つまり、PICSの発生そのものを減らすだけでなく、救命後の「生活の質」や「社会復帰の可能性」を改善する効果があります10)12)。
E:Early Mobility & Exercise(早期離床)の効果
Early Mobility & Exerciseに焦点を絞って見てみます。
早期離床は「安全に実施できるか」「本当にアウトカムが改善するのか」という2点が常に問われます。
結論から言えば、安全性は担保しつつ、機能・せん妄・在院期間など複数の臨床転帰で有益であることを示す研究が蓄積しています。13)14)16)18)
機能転帰(退院時の自立度・筋力・運動耐容能)
- 人工呼吸器装着患者を対象としたRCTでは、日次の鎮静中断と理学・作業療法を組み合わせることで、退院時の機能的自立(独立歩行/ADL自立)達成率が上昇、せん妄持続日数も短縮しました。13)
- ICUでの早期理学療法導入は、機能回復の促進とICU/病院在院の短縮に関連し、費用増なく実施可能でした。14)
- ベッドサイド・エルゴメーターを用いたRCTでは、退院時の6分間歩行距離・健康関連QOL(SF -36)・筋力が有意に改善し、短期ながら実用的な運動耐容能の回復を示しました。15)
- 系統的レビュー/メタ解析でも、筋力や身体機能の改善に一貫した効果が示され、エビデンスは漸増しています。16)18)
せん妄・鎮静関連アウトカム
- 早期離床はせん妄の発症/持続を減らすことが複数研究で示され、せん妄日数の短縮が主要所見の一つでした。13)
- 早期離床は過鎮静の回避や覚醒の促進と相補的に働き、ABCDEFバンドル全体の効果を押し上げる要でもあリマした(E単独でなくA–Dとの連動が重要)。10)12)
在室日数・人工呼吸器日数・退院後転帰
- プロトコル化された早期離床の実施は、ICU在室・病院在院の短縮、人工呼吸器離脱促進に関連するとの報告があります。14)16)18)
- PICS関連の短期機能アウトカム(筋力・ADL能力・QOL改善)は改善し得る一方、長期のエンドポイント(長期QOL・死亡)は結果にばらつきがあり、大規模RCTの継続的蓄積が必要とされています。17)18)
早期離床を実施する上での安全性
ただし、早期離床にはリスクが完全にゼロというわけではありません。
実際、Hodgsonの報告では、371 名中 34 名(9.2 %)で早期離床に起因する可能性のある 不整脈、血圧変動、酸素飽和度低下等の有害事象が報告されています19)。
また、Paton らによる研究では、能動的モビライゼーション(early active mobilization)つまり、患者の筋収縮を伴うレベルの運動をICU滞在中に開始した介入群において、身体機能改善の可能性はあるが、死亡率や有害事象のリスク増加も否定できず、特に人工呼吸器管理中や高強度な介入では、有害事象の発生率が高まる可能性あると報告しています。20)。
こうした報告は多くは発生率が低い水準ですが、「過剰実施によるリスク」の警鐘と捉えるべきです。特に、重症患者では循環動態不安定性、人工呼吸器装着やカテーテル、チューブが多数挿入されていることなど、早期離床による過負荷が生じやすい可能性があります。
だからこそ、理学療法士は「単に離床する」ではなく、集中治療下で安全を考慮したやりすぎでもなく、やらなさすぎでもないクリティカルな離床を見極められる専門家でなければなりません。
具体的には、
- 早期離床の実施前後のバイタルサインの変化や灌流が維持できているかの把握
- 中止基準を厳格に設け、逐次モニタリングを行う体制
- 患者の状態(昇圧薬使用、酸素補正、循環器的バックグラウンドなど)を理解した上での負荷調整
- 他職種(医師・看護師など)とのリアルタイムな連携
といった取り組みが不可欠になると私は感じています。
有害事象報告の存在は、決して早期離床を否定する根拠ではありません。質と安全性を担保しながら実行する必要性を示していると言えます。
集中治療理学療法士という資格の背景
集中治療におけるリハビリテーションの質と安全を担保するために、日本では「集中治療領域で働く理学療法士のためのミニマムスタンダード」が策定されました。この基準は海外(オーストラリア・ニュージーランド、南アフリカ、イギリス)の報告を参考に作成され、さらに医師・看護師・理学療法士による合意形成を経て完成したものです 21)22)。
この合意に基づくスタンダードをもとに「集中治療理学療法テキスト」が編纂され、その内容を試験範囲とした「集中治療理学療法士認定試験」が実施され、試験を合格した方が集中治療理学療法士の認定を受けています。
つまり、集中治療理学療法士という資格は、国際的な知見と国内の多職種合意を背景に、質や安全を保証するための制度であり資格と言っていいと思います。
早期離床はどのように行うのか
重症患者に対するリハビリテーションは、各施設でプロトコルを作成し、それに基づいて導入することが望ましいとされています 23)。プロトコル化された介入は、安全性の担保や多職種間の連携強化につながり、標準化された医療の質を確保する上で重要です。
しかし、現実的にはすべての施設で十分に整備されたプロトコルが存在するとは限りません。そのような環境では、ガイドラインで示されている「離床開始基準」「離床中止基準」を個々の臨床判断の材料として参照しながら、患者ごとに安全かつ適切な離床を進めていくことが現実的なアプローチとなります。
実際の「開始基準」や「中止基準」の詳細については、日本集中治療医学会『重症患者リハビリテーション診療ガイドライン2023』 に整理されていますので、そちらを参照してください 23)。
実際に私自身が臨床で離床の可否を判断するときには、次の4つの視点を重視しています。
- 意識
離床を実施できるだけの意識レベルにあるかを確認します。RASSやGCSといった評価ツールを用い、反応性や指示理解が可能かどうかを判断します。 - 疼痛
自己表出が可能な患者はNRSやVASで、鎮静中など自己表出がこんなんな患者はCPOTやBPSといった他覚的に疼痛を評価するスケールを用いて確認します。疼痛が十分にコントロールされていなければ離床は困難です。 - 呼吸
人工呼吸器の設定(PEEP、FiO₂など)や呼吸数、自発呼吸の努力の有無を評価し、離床中に呼吸状態が不安定にならないかを検討します。 - 循環
MAPや昇圧薬の使用状況などを含め、循環動態が安定しているかを確認します。
これらの意識・疼痛・呼吸・循環の4項目には、いずれもガイドラインに明確な判断基準が設けられており、私はそれを一つの“ものさし”として総合的に活用しています。各項目を基準に沿って順にチェックし、すべてクリアできていれば「離床可能」と判断します。
さらに私自身の臨床では、疾患の治療経過(改善傾向にあるか、コントロールされているか)を医師と確認し、離床を安全に進められる状況かどうかを必ず協議します。そのうえで、離床の具体的な目標設定(その日は端座位までにとどめるのか、段階的に立位・歩行まで進めるのかなど)を医師・看護師とともに多職種で共有し、チーム全体で合意したゴールを目指して離床を実施します。
基準だけでなく灌流を意識する
離床の可否を判断する際には、主に意識・疼痛・呼吸・循環の4項目を基準としますが、本質的に最も重視すべきは 「灌流が維持できているかどうか」 です。
私は臨床のなかで、
- 安静時に灌流が安定しているか
- 離床によって不安定となる可能性はないか
- 不安定化を引き起こす最大の要因は何か
といった視点を常に意識しています。
具体的な評価指標としては、
- 離床開始前の判断材料:尿量の推移、乳酸値の動向
- 離床実施中の判断材料:平均動脈圧(MAP)、皮膚灌流指標(例:キャピラリーリフィルタイム)
を活用します。これらの指標を基に、離床前には全身の灌流状態が十分に安定しているかを確認し、実施中には運動負荷によって灌流が破綻していないかを逐次評価し続けることが不可欠です。
運動中止はどのように判断するか
中止基準についても、私はガイドラインに示された数値を一つの“ものさし”として順にチェックしています。これにより客観的に「続行可能か、中止すべきか」を判断できます。
ただし実際の臨床では、灌流が維持できなくなったサインとして、数値だけでは捉えきれない「負荷症状」が現れることがあります。具体的には、
- 末梢冷感や皮膚の湿潤
- 呼吸様式の変化
- 呼吸数の増加
といった変化です。これらはモニターを介さずとも目で見て、手で触れて気づける所見であり、私は離床を行う際には常に神経を研ぎ澄ませて観察しています。
つまり、数値基準とベッドサイドでの身体所見の両方を組み合わせて評価することが、安全で的確な離床の鍵になると考えています。
離床できない場合の対応 ― 低周波刺激によるICU-AW予防
ICUに入室する患者のなかには、重症度が極めて高く、離床を実施できないケースが一定数存在します。こうした患者についても、毎日多職種チームで離床の可否を検討しますが、長期間の臥床を余儀なくされることがあります。
このような状況に対して、重症患者リハビリテーション診療ガイドラインでは、CQ3:重症患者に対して低周波刺激を導入するべきか? というクリニカルクエスチョンが示されています。その推奨度は 2B とされており、低周波刺激(Neuromuscular Electrical Stimulation: NMES)による筋収縮は筋力低下やICU-AW(ICU-acquired weakness)の予防に有効である可能性があると報告されています23)。
私自身の臨床でも、全身状態が改善し、離床を実施できるようになるまでの“つなぎ”として、低周波刺激を取り入れる意義は大きいと感じています。
もっとも、現実的な導入の障壁として診療報酬上の加算がつかないことがあり、施設や体制によって実装度に差があるのが現状です。
ICU退室後も継続するPICSの特異的評価
先に述べたように、PICSは 身体的・認知的・精神的障害の3要素と、家族に生じるPICS-Fから構成されます。これらを的確に把握するためには、標準化された評価ツールを用いることが推奨されています。
具体的には、以下のツールが代表的です。
- 身体機能障害
・MRCスコア(筋力評価)
・6分間歩行距離(運動耐容能評価) - 認知機能障害
・MoCA-J(Montreal Cognitive Assessment – Japanese version)
・MMSE-J(Mini-Mental State Examination – Japanese version) - 精神障害
・HADS(Hospital Anxiety and Depression Scale:不安・うつ)
・IES-R(Impact of Event Scale-Revised:PTSD評価) - QOL(生活の質)
・SF-36
・EQ-5D-5L - PICS-F(家族への影響)
・HADS(不安・うつ)
・IES-R(PTSD)
・PSQI(Pittsburgh Sleep Quality Index:睡眠障害)
これらの評価方法は、『ICUが変わる!PICS診療実践マニュアル』(羊土社)で整理されており抜粋したものです。これらの評価ツールはスコーピングレビューとデルファイ法を用いた検討を経て選定されたものです。
そのため、これらの評価ツールをICU入室中から退室後まで継続的に活用することは、PICSやPICS-Fの発症を早期に把握し、適切な介入につなげるために重要であると考えられます。
PICS診療の現在位置
PICSについては、これまでの研究により 患者の長期予後が不良であること は明らかになってきました。しかし一方で、PICSを発症した患者に対してどのような介入が有効であるかについては、依然として確立されたエビデンスが不足しているのが現状です。
そのため、現時点で私たちが臨床で実践できることは限られていると考えます。
具体的には、
- 適切な栄養管理:筋量維持や回復促進を目的とした栄養サポート
- 運動療法の継続:可能な範囲での活動・リハビリテーション介入を続けること
- 精神障害への対応:不安やうつ、PTSDといった症状がみられる場合には、精神科やリエゾンチームへの紹介による専門的介入
といった取り組みが中心となります。
つまり、PICSに対して「これをすれば確実に予後が改善する」という治療法はまだ存在しないものの、現状でできる最善の対応を積み重ねることが重要です。
参考文献一覧
- Desai SV, Law TJ, Needham DM. Long-term complications of critical care. Crit Care Med. 2011;39(2):371–379.
- Inoue S, Hatakeyama J, Kondo Y, et al. Post-intensive care syndrome: its pathophysiology, prevention, and future directions. Acute Med Surg. 2019;6(3):233–246.
- Oeyen SG, Vandijck DM, Benoit DD. Quality of life after intensive care: a systematic review of the literature. Crit Care. 2010;14(4):R146.
- Herridge MS, Cheung AM, Tansey CM, et al. One-year outcomes in survivors of the acute respiratory distress syndrome. N Engl J Med. 2003;348(8):683–693.
- Hill AD, Fowler RA, Pinto R, et al. Long-term outcomes and healthcare utilization following critical illness – a population-based study. Am J Respir Crit Care Med. 2016;194(6):681–690.
- Sviri S, et al. Readmissions to medical intensive care units: a population based study. Crit Care Med. 2009;37(11):3157–3163.
- Kamdar BB, Suri R, Suchyta MR, et al. Return to work after critical illness: a systematic review and meta-analysis. Thorax. 2020;75(1):17–27.
- Davidson JE, Jones C, Bienvenu OJ. Family response to critical illness: postintensive care syndrome–family. Crit Care Med. 2012;40(2):618–624.
- Skoretz SA, Riopelle SJ, Macdonald AM, et al. Dysphagia and associated outcomes in critically ill adults. Crit Care. 2019;23:103.
- Balas MC, et al. Implementing the ABCDEF bundle into everyday care: evidence-based strategies for improving patient outcomes in the ICU. Crit Care Med. 2014;42(2):102–115.
- Devlin JW, Skrobik Y, Gélinas C, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med. 2018;46(9):e825–e873.
- Pun BT, et al. Caring for critically ill patients with the ABCDEF bundle: results of the ICU Liberation Collaborative in over 15,000 adults. Crit Care Med. 2019;47(1):3–14.
- Schweickert WD, et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: a randomized controlled trial. Lancet. 2009;373(9678):1874–1882.
- Morris PE, et al. Early intensive care unit mobility therapy in the treatment of acute respiratory failure. Crit Care Med. 2008;36(8):2238–2243.
- Burtin C, et al. Early exercise in critically ill patients enhances short-term functional recovery. Crit Care Med. 2009;37(9):2499–2505.
- Kayambu G, Boots R, Paratz J. Early rehabilitation in sepsis: a prospective randomised controlled trial exploring physical function and health-related quality of life. Intensive Care Med. 2015;41(6):971–979.
- Tipping CJ, Harrold M, Holland A, et al. The effects of active mobilisation and rehabilitation in ICU on mortality and function: a systematic review. Intensive Care Med. 2017;43(2):171–183.
- Waldauf P, Jiroutková K, Krajčová A, et al. Effects of physiotherapist-led early mobilization of ICU patients: a systematic review and meta-analysis. Ann Intensive Care. 2020;10:22.
- Hodgson CL, et al. “Early Active Mobilization during Mechanical Ventilation in the ICU.” N Engl J Med. 2022 Nov 10;387(19):1747-1758. doi:10.1056/NEJMoa2209083
- Paton M, et al. “The Effect of Mobilization at 6 Months after Critical Illness.” NEJM Evidence. 2023. doi:10.1056/EVIDoa2200234
- Kawaguchi M, et al. Minimum standards of clinical practice for physical therapists working in intensive care units in Japan. Phys Ther Res. 2021;24(1):52–68.
- 川口正一郎,他.集中治療領域で働く理学療法士のためのミニマムスタンダード:医師、看護師および理学療法士による合意形成.日集中医誌. 2021;28:237–54.
- 日本集中治療医学会.重症患者リハビリテーション診療ガイドライン2023(J-ReCIP 2023).日集中医誌. 2023;30(Suppl 2):S1–S84.

